1; Démokritosz (ókori görög filozófus, természettudó, i.e.~ 470-460 - 370 körül)

Az atom parányi anyagi részecske.
2; Higany-oxid bomlása
1; A kalcium égése
2; A kalcium reakciója vízzel
3; Mészégetés
4; Mészoltás
1; A nátrium reakciója vízzel
2; A nátrium-klorid képződése (nátrium és klór reakciója)
A hidrogén és az oxigén
1; A hidrogén
2; Az oxigén
1; A szén-dioxid előállítása, kimutatása, vízben való oldódása
2; A szénsav kimutatása, bomlása
3; A szén-monoxid mérgezés jelei és hatása az emberi szervezetre
1; A salétromsav reakciói fémekkel
a; tömény salétromsav
b; híg salétromsav
2; Királyvíz (3:1 sósav salétromsav elegye)
4; Bejrúti robbanás
1; Folyékony nitrogén
2; Nitrogén-dioxid
3; Ammónia szökőkút kísérlet
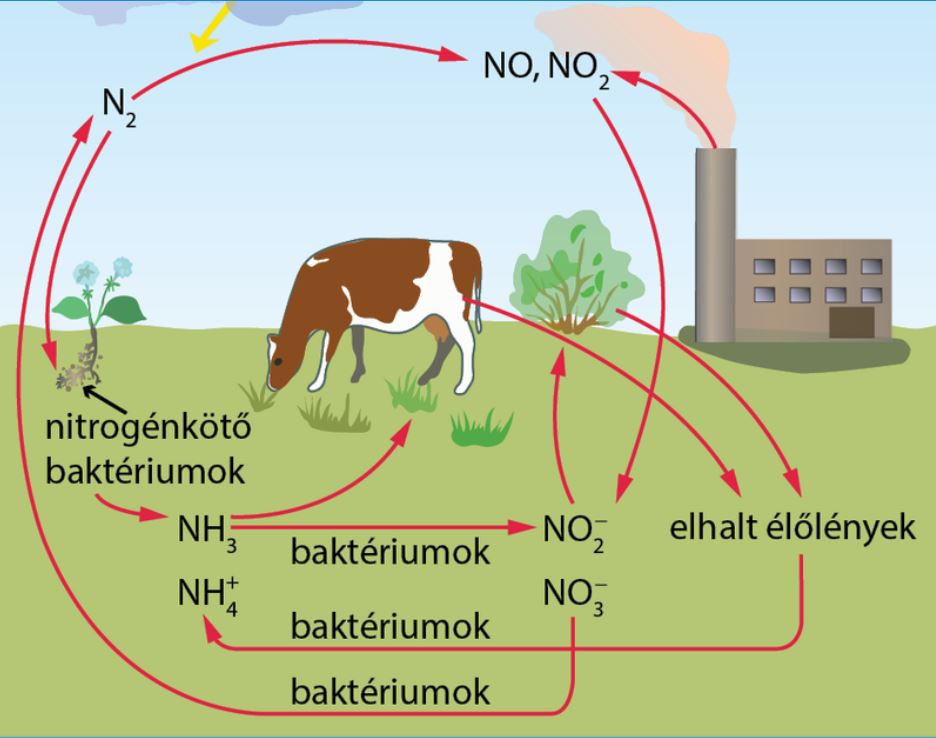
3; A nitrogén körforgása
2; A rézgálic kristályosítása
1; A kénsav reakciói
a; vízzel
b, szerves vegyületekkel (papírral; cukorral)
c; fémekkel
híg kénsav
tömény kénsav
